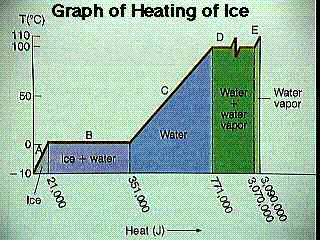
물질의 경우 현열/잠열 그래프는 온도 범위에 따른 물질의 에너지를 차트로 표시합니다. 즉, 이러한 그래프는 온도와 물질의 내부 에너지 사이의 관계를 나타냅니다.
오른쪽 그래프에서는 어느 정도의 에너지가 얼음에 추가됩니다. 얼음의 온도는 32F에 도달할 때까지 상승합니다(현명한 범위에 있음). 이 지점에서 물질의 온도는 변하지 않습니다(이제 잠복 범위에 있음). 얼음이 모두 녹고 물질이 완전히 물이 되면 온도가 다시 상승하기 시작하고 우리는 다시 합리적인 범위에 있게 됩니다. 물이 증발하기 시작하면 온도 상승이 멈추고 다시 잠복 범위에 들어갑니다. 물이 모두 증발할 때까지 온도는 상승하지 않으며, 이 시점에서 더 많은 에너지가 추가됨에 따라 증기는 계속해서 뜨거워집니다.
예를 들어, 섭씨 20도의 물 500mL를 섭씨 0도까지 낮추려면 얼마나 많은 에너지가 필요합니까? 물의 열용량은 1칼로리/그램 ℃입니다. Q=mcΔT를 사용하세요.
따라서 Q= 500mL * 1g/mL * 1칼로리/g ℃ ℃ *(0C- 20C)
따라서 Q는 -10,000칼로리이며, 이는 물을 0C로 냉각하는 데 필요한 에너지입니다.
현열
현열은 가장 간단하게는 여러분이 느낄 수 있는 열 에너지입니다. 물질의 온도를 높이는 데 필요한 열입니다. 물질에 더 많은 에너지가 추가되고 해당 물질의 온도가 상승하면 이것이 현열입니다. 현열은 다음 방정식으로 이해될 수 있습니다.
Q= mcΔT
여기서 Q는 현열
m은 물질의 질량
c는 물질의 비열 용량(표에서 찾아볼 수 있음)
ΔT는 물질의 온도 변화
열용량은 물질을 단위 온도만큼 변화시키는 데 필요한 에너지의 양입니다. 비열은 열용량/단위 질량으로 구할 수 있습니다. 일반적인 열 단위에는 물 1파운드를 화씨 1도 올릴 수 있는 것으로 정의되는 Btu(영국 열 단위)와 물 1그램을 섭씨 1도 올릴 수 있는 칼로리(cal)가 있습니다.
잠열
잠열(또는 숨겨진) 열은 시스템의 온도를 변경하지 않고 시스템이 흡수하는 에너지입니다. 이러한 유형의 열은 일반적으로 상 변화에서 발생합니다. 예를 들어, 얼음을 녹일 때 얼음이 완전히 녹을 때까지 얼음의 온도는 32F를 초과하지 않습니다. 마찬가지로, 물이 끓을 때 물의 온도는 모든 물이 끓을 때까지(STP에서) 212F를 초과하지 않습니다.
물질의 융해열은 물질을 완전히 녹이는 데 필요한 에너지입니다. 기화열은 물질을 완전히 기화시키는 데 필요한 에너지입니다.